Nel post precedente se ne era parlato, non abbiamo approfondito molto il concetto, ho preferito dedicargli un post tutto suo, seppur piccolo. In seguito ci torneremo ancora su, per approfondire meglio anche la loro applicazione a livello proteico.
Gli amminoacidi non naturali sono stati ampiamente utilizzati in varie ricerche, e ancora oggi sono al centro della ricerca farmaceutica e non solo; la loro caratteristica principale è stata quella di essere utilizzati per modificare il comportamento delle proteine, migliorando la funzionalità di certi enzimi, o rendendo meno flessibile la conformazione delle proteine, migliorando la farmacodinamica e la biodisponibilità di certi farmaci. I beta amminoacidi, anche se meno numerosi degli alfa amminoacidi, si trovano in prodotti naturali con importanti applicazioni farmacologiche. Sono precursori di sintesi di composti beta lattamici e componenti chiave nella funzionalità di potenti enzimi con funzione inibitoria come le statine, pepstatina e amastatina. Molti prodotti farmaceutici contengono questi peptidi modificati.
Vediamo qualche esempio, elencando alcune delle molecole più utilizzate in ambito farmaceutico.
Amminoacidi non naturali usati in farmaceutica, un esempio è L-Dopa che viene usato nel morbo di Parkinson.
La D-penicilammina: come si può vedere dall'immagine è strutturalmente simile all'amminoacido cisteina, la diferenza risiede al terzo atomo di carbonio della catena dove sono presenti due gruppi metilici. Deriva dall'idrolisi dell'antibiotico penicillina, ma non ha attività anti batterica.
viene principalmente usata come terapia per la malattia di WIlson, malattia caratterizzata da un disordine genetico che causa un accumulo di rame nei tessuti. Questa molecola ha infatti la capacità di chelare lo ione rame permettendone una facile eliminazione dalle urine.
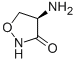
D-cicloserina: è un analogo strutturale della D-alanina, inibisce in maniera competitiva due enzimi che partecipano alla formazione del dipeptide D-alanil-D-alanina, passaggio fondamentale nella sintesi della parete celluare. Gli enzimi coinvolti in questo meccanismo sono la racemasi che converte l'amminoacido L-alanina nello stereoisomero D; e la sintetasi che catalizza la formazione del legame peptidico, tra le due molecole D-alanina.
La cicloserina è una molecola ciclica come si può vedere dalla figura, la stabile struttura ad anellofavorisce la formazione di un legame stabile con la racemasi e la sintetasi, preferenzialmente rispetto ai substrati naturali,
ciò risulta in una inibizione competitiva di questi enzimi. La cicloserina è neurotossica e non viene usata se non per il trattamento da infezioni causate da Mycobacterium tubercolosis resistente agli altri farmaci.
D-4-idrossifenilciclina (amoxicillina): è un analogo strutturale della fenilalanina, la D-4-idrossifenilciclina fa parte della struttura dell'amoxicillina (vi risparmio la nomenclatura IUPAC!!!). Appartiene al gruppo delle penicillline, l'amoxicillina è un antibiotico usato nel trattamento di infezioni batteriche. Come tutte le penicilline anche l'amoxicillina interferisce con l'ultima tappa della sintesi della parete cellulare batterica (traspeptidazione) con conseguente esposizione della membrana celilare, osmoticamente meno stabile all'ambiente esterno. In questo modo viene facilitata la lisi cellulare mediante pressione osmotica.
D-fenilglicina (Ampicillina): l'ampicillina appartiene al gruppo delle penicilline.



Nessun commento:
Posta un commento